腫瘍浸潤リンパ球療法(アファミセル)がアメリカで承認
アメリカで、我々の免疫細胞治療の一種、腫瘍浸潤リンパ球療法(TIL)が正式承認されました。
今後、他の免疫細胞治療(NK細胞等)の承認も進むのではないでしょうか?
ご期待ください。
『Afamitresgene autoleucel for advanced synovial sarcoma and myxoid round cell liposarcoma (SPEARHEAD-1): an international, open-label, phase 2 trial』
LANCET March 27, 2024
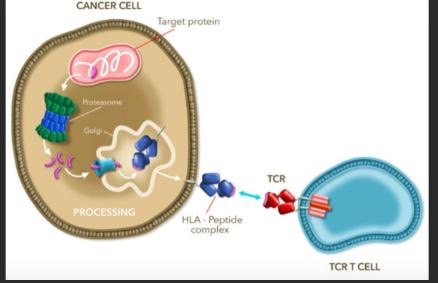
腫瘍浸潤リンパ球療法(TIL)とは言葉のごとく、がんに入り込んでいる(浸潤して、攻撃している)リンパ球を取り出し、増やして戻す治療法です。私たちも以前TILの研究開発にかかわってきました。
背景:
アファミセルは、第1相試験(NCT03132922)で許容できる安全性と有望な効果を示しました。
この研究の目的は、HLA-A*02およびMAGE-A4を発現する進行性滑膜肉腫または粘液性円細胞脂肪肉腫患者の治療におけるアファミセルの有効性を評価することです。
方法:
SPEARHEAD-1は、オープンラベル、第2相試験です。
この試験には3つのコホートが含まれており、主要調査コホート(コホート1)です。
コホート1には、HLA-A*02を有する、16歳から75歳までの患者が含まれており、MAGE-A4を発現し、少なくとも1つのアントラサイクリンを含む化学療法またはイフォスファミドを含む前治療を受けた転移性または切除不能滑膜肉腫または粘液性円細胞脂肪肉腫患者でした。
患者はリンパ球除去療法後にアファミセル(投与量範囲1.0×109〜10.0×109 T細胞)単回静脈投与を受けました。
主要評価項目は、コホート1における全体的反応率であり、固形腫瘍評価基準(バージョン1.1)を用いて評価されました。
結果:
2019年12月17日から2021年7月27日までの間に、HLA-A*02陽性滑膜肉腫(n=44)および粘液性円細胞脂肪肉腫(n=8)の患者52人がコホート1でアファミセルを受けました。
患者は前治療を受けていました(前治療の中央値は3回[IQR 2〜4回])。
中央フォローアップ時間は32.6ヶ月でした(IQR 29.4〜36.1)。
全体反応率は、全体で37%(52人中19人; 95% CI 24-51)、滑膜肉腫患者で39%(44人中17人; 24-55)、粘液性円細胞脂肪肉腫患者で25%(8人中2人; 3-65)でした。
サイトカイン放出症候群は、52人中37人(71%)で発生しました(1つのグレード3イベント)。
サイトペニアは最も一般的なグレード3以上の有害事象であり、リンパ球減少症52人中50人(96%)、好中球減少症44人(85%)、白血球減少症42人(81%)でした。治療関連死亡例はありませんでした。
解釈:
アファミセル治療は、HLA-A*02およびMAGE-A4を発現する滑膜肉腫患者に対して持続的な反応をもたらしました。
この研究は、T細胞受容体療法を使用して固形腫瘍を効果的に標的とすることができることを示し、このアプローチを他の固形悪性腫瘍に拡大する合理的な根拠を提供しています。
 プレシジョンクリニック名古屋院院長
プレシジョンクリニック名古屋院院長
岡崎監修 
